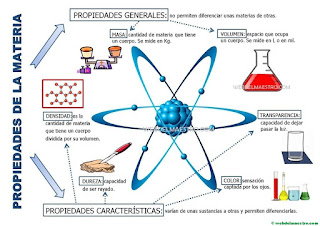
ESTRUCTURA DE LA MATERIA
La
materia consiste de partículas extremadamente pequeñas agrupadas juntas para
formar el átomo. Hay unas 90 ocurrencias naturales de estas agrupaciones de
partículas llamadas elementos. Estos elementos fueron agrupados en la tabla
periódica de los elementos en secuencia de acuerdo a sus números atómicos y
peso atómico. Hay además 23 elementos hechos por el hombre que no ocurren en la
naturaleza, por lo que al final son unos 113 elementos conocidos hasta la
fecha. Estos elementos no pueden cambiarse por procesos químicos. Ellos solo
pueden ser cambiados por reacción nuclear o atómica, sin embargo pueden ser
combinados para producir el incontable número de compuestos con los que
tropezamos día a día. (Montaño, 2019)
|
Fuente:
https://webdelmaestro.com/las-propiedades-la-materia-4o-nivel/
Elaborado: Odalys Montaño Fernandez |
Estructura del átomo
Un
átomo puede ser representado simbólicamente en un modelo que recrea nuestro
sistema solar, el cual tiene en el centro el sol y los planetas girando en
órbitas alrededor de él. Este modelo atómico, representado en la figura 1 fue
propuesto por el físico Danés, Niels Bohr en 1913. Los mecanismos cuánticos
actuales han demostrado que este modelo no es exactamente correcto, pero sigue
siendo útil para la visualización de átomo. El centro del átomo se llama núcleo
y está principalmente formado por las partículas llamadas Protones y Neutrones,
los que constituyen la mayoría de la masa del átomo. Orbitando alrededor del
los núcleos están pequeñas partículas llamadas electrones. Estos electrones tienen
una masa muchas veces mas pequeña que el Protón y el Neutrón. Hay otras
partículas sub-atómicas estudiadas por los físicos atómicos, pero estas tres
son suficientes para nuestro propósito. Todos los elementos de la tabla
periódica están formados por las tres partículas con la sola excepción del
Hidrógeno que tiene un núcleo formado por un protón simple, alrededor del cual
gira orbitando un electrón. El protón y el neutrón tienen una masa de alrededor
de 1840 veces la masa del electrón. (Montaño, 2019)
Número y peso atómicos
Los
elementos se identifican por su número y masa atómicos. Normalmente, un átomo
tiene igual número de protones en su núcleo que de electrones girando alrededor
de él. El número de protones del núcleo constituye el número atómico del
elemento. De manera simplificada la masa atómica de un elemento es
numéricamente igual al total de partículas mayores (protones y neutrones) en el
núcleo. Uno de los primeros elementos estudiados por los científicos fue el
oxígeno. Después de la investigación, en el núcleo del oxígeno se encontraron 8
protones y 8 neutrones, por lo que le fueron asignados 16 como peso atómico y 8
como número atómico.
Niveles y sub-niveles
Los electrones que giran alrededor del núcleo los
hacen agrupados en anillos u órbitas. Esas órbitas se tratan como niveles de
energía los que a su vez contienen además sub-niveles. Cada nivel y sub-nivel
de energía dependiendo de la distancia al núcleo contiene un cierto número
máximo de electrones que no puede excederse. El primer nivel puede tener 2
electrones, el segundo 8 (2 en el primer sub-nivel y 6 en el segundo), el
tercero puede contener 18 (2, 6, 10), el cuarto puede contener 32 (2, 6, 10,
14), etc.
El
último nivel de energía de un átomo se llama nivel de valencia y puede estar
lleno con el número máximo de electrones permitidos o tener electrones en
defecto. Como este último nivel de energía está incompleto puede aceptar o
ceder alguno de los electrones a otro átomo de otro elemento que cumpla la
misma condición y así formar uniones de átomos diferentes que comparten uno o
mas electrones. Este enlace de átomos constituye la base de la comprensión de
las reacciones químicas para formar sustancias complejas a partir de elementos
simples. Cuando el último nivel está completo el átomo no puede compartir
electrones siendo una sustancia muy estable y que no forma compuestos con otros
elementos en condiciones normales, estas sustancias son los llamados gases
nobles, Helio Argón Xenón etc.
Carga eléctrica
Los
protones y electrones ejercen fuerzas mutuas entre ellos, más o menos como si
existiera una fuerza gravitacional entre ellos, por lo que se ha supuesto que
las masas de estas partículas son portadoras de cierta carga eléctrica y que la
fuerza de interacción entre ellas es entonces una fuerza eléctrica. En la
práctica estas fuerzas eléctricas son de atracción entre partículas de
naturaleza diferente (protones y electrones) y de repulsión entre las
partículas de la misma naturaleza al igual que los polos de un imán, esto hace
pensar en cargas de diferente naturaleza las que han sido convencionalmente
denominadas positiva (+) para el protón y negativa (-) para el electrón. Se ha
demostrado además que las magnitudes de las cargas de las partículas con
independencia de la enorme diferencia de masa son iguales, por lo que el átomo
normal (misma cantidad de protones y electrones) es una entidad neutra
eléctricamente hablando. Esta carga de las partículas elementales es la menor
cantidad de carga eléctrica que puede existir por lo que se ha convenido en
denominar carga elemental. (Montaño, 2019)
|
Elaborado: Odalys Montaño
|
El electrón
El
electrón es una partícula elemental. Esto significa que no se descompone
en otras partículas. Según el modelo estándar de la materia, toda la materia
que vemos en el universo se compone de cuatro partículas elementales:
electrones, quarks up, quarks down y neutrinos. En el modelo físico de la
mecánica cuántica, el electrón es una partícula puntual y no tiene volumen.
Pero no hay ningún problema para que se le asigne un momento
angular (una rotación). Podemos pensar en que el electrón es como una
bolita que gira sobre sí misma. Este momento angular se denomina espín y
está cuantizado; es decir, que no puede tener cualquier valor, sino múltiplos
de una cantidad mínima, que es 1/2 de la constante reducida de Planck. El
electrón, al igual que todas las partículas elementales (cuatro en cada una de
la tres familias), tiene espín de valor 1/2. A las partículas que tienen
espín 1/2 , se las denomina fermiones, en honor del físico italiano Enrico
Fermi (1901-1954). Es interesante saber que, en todos los astros, por cada
protón hay un electrón. Esto hace que todos los astros sean neutros
eléctricamente: el número de cargas positivas es exactamente igual al número de
cargas negativas. Aunque parezca increíble, si así no fuera, la fuerza de
gravedad sería insuficiente para asegurar la cohesión de la materia del astro y
éste explotaría. Pulse en la imagen, para saber más acerca de Enrico
Fermi.
El protón
El
protón tenemos que dejar patente que fue descubierto en los primeros compases
del siglo XX por el científico Ernest Rutherford. Concretamente en el año 1918
fue cuando dio a conocer la existencia de ese elemento. No obstante, otras
figuras que abordaron dicha temática son J.J. Thompson o Eugene Goldstein. En
el caso del ámbito de la Química hay que subrayar el hecho de que cuando se
habla de protón se está haciendo referencia a varios elementos posibles. Por un
lado, aquel puede ser el catión de hidrógeno y también puede emplearse como el
número atómico de protones que tiene un átomo en cuestión. Los protones se
clasifican dentro la categoría de bariones (las partículas subatómicas formadas
por tres quarks). En el caso específico de los protones, están compuestos por
dos quarks arriba y un quark abajo. Su equivalente de antimateria es el
antiprotón o protón negativo, con la misma magnitud de carga pero signo
contrario.La acción de la fuerza electromagnética hace que la carga del protón
sea opuesta e igual (en valor absoluto) a la carga del electrón. Las
propiedades de los protones permiten la espectroscopía de resonancia magnética
nuclear, una técnica que consiste en la aplicación de un campo magnético a una
sustancia para detectar la corteza existente alrededor de los protones en el
núcleo.
El neutrón
Un
neutrón es una partícula masiva sin carga eléctrica. Se trata de un barión (una
partícula subatómica compuesta por tres quarks) formado por dos quarks abajo y
un quark arriba. Los neutrones y los protones constituyen los núcleos de los
átomos. El neutrón tiene una vida media de unos quince minutos fuera del núcleo
atómico, cundo emite un electrón y un antineutrón para convertirse en protón.
Los neutrones, que tienen una masa similar a los protones, son necesarios para
la estabilidad de los núcleos atómicos (con la excepción del hidrógeno). Otros
experimentos realizados posteriormente hicieron que se descartara la idea del
dipolo y establecieron la naturaleza de los neutrones, tal como se acepta actualmente.
Los neutrones son fundamentales en las reacciones nucleares: cuando un neutrón
impacta con un átomo fisible, se produce un mayor número de neutrones que
causan a su vez otras fisiones en cadena. Si esta reacción se produce de forma
controlada mediante el uso de un moderador en el reactor nuclear, es posible
aprovechar la energía nuclear desarrollada.
El positrón o electrón positivo
Positrón. Electrón con carga positiva.
La interacción con el electrón puede resultar en la aniquilación de ambos, con
lo que se produce un par de fotones cuya energía equivale a
la masa del par electrón-positrón. Esta propiedad define al positrón como la
antipartícula asociada al electrón. Es la antipartícula correspondiente al
electrón, por lo que posee su misma masa y carga eléctrica (aunque de
diferente signo, ya que es positiva). No forma parte de la materia ordinaria,
sino de la antimateria, aunque se producen en numerosos
procesos radio químicos como parte de transformaciones nucleares.
El
antielectrón es tan estable como el electrón, de hecho, es idéntico al electrón
en todos sus aspectos, excepto en su carga eléctrica. Su existencia puede ser
indefinida. Aunque el promedio de vida es de una millonésima de segundo, hasta
que se encuentra con un electrón, durante un momento relampagueante quedaran
asociados el electrón y el positrón; ambas partículas giraran en torno a un
centro de fuerza común. Pero la existencia de este sistema, como máximo, durará
una diezmillonésima de segundo ya que se combinan el positrón y el electrón.
Cuando se combinan las dos partículas opuestas, se produce una neutralización
mutua y literalmente desaparecen, no dejan ni rastro de materia (aniquilamiento
mutuo). Pero como se sabe la materia al igual que la energía no puede
desaparecer, como resultado de esto queda la energía en forma de radiación
gamma. De tal forma como había sugerido el genio Albert Einstein: la
materia puede convertirse en energía, y viceversa. (Montaño, 2019)
|
Fuente: https://www.bautistasanz.com/viajan-los-electrones-por-los-cables-electricos-a-la-velocidad-de-la-luz/.
Elaborado: Odalys Montaño
|




Comentarios
Publicar un comentario